Função Base
Por Redação
3. Quanto à força do ácido
A força de um ácido depende do seu grau de ionização (?). O grau de ionização é a relação entre o número de moléculas ionizadas (ni) e o número de moléculas dissolvidas (nd).
![]()
Ácido forte (a![]() 50%)
50%)
HCl (91%) e H2SO4 (61%)
Ácido moderado (5%![]() < 50%)
< 50%)
HF(8,5%) e H3PO4 (27%)
Ácido fraco (a < 5%)
HCN (0,008%) e H2CO3 (0,18%)
Observação 1 – Entre os hidrácidos temos:
Hl > HBr > HCl >>>HF >HCN, H2S…
Fortes Moderado Fracos
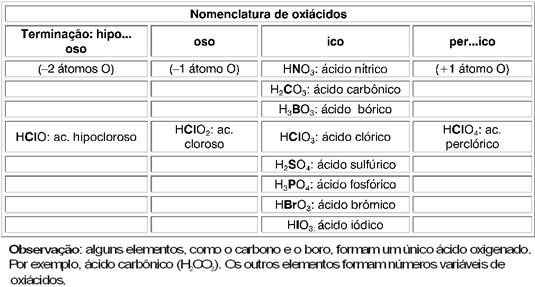
Observação – Podemos ter uma idéia da força de um oxiácido fazendo a diferença entre o número de átomos de oxigênio e o número de hidrogênios ionizáveis (H+) contidos na molécula do ácido.
HxEOy (fórmula geral do ácido)
Se y – x = 0, ácido fraco.
Se y – x = 1, ácido moderado (exceção: H2CO3(aq) que é fraco).
Se y – x = 2 ou 3, ácido forte.
Exemplos:
a) HNO3 , y – x = 3 – 1 = 2 (ácido forte);
b) H3BO3 , y – x = 3 – 3 = 0 (ácido fraco)
Função base
Base – É toda substância que se dissocia em água fornecendo exclusivamente o ânion hidroxila (OH– ), de acordo com a teoria de Arrhenius.
Veja as dissociações, em meio aquoso, abaixo:
a) KOH(aq) ![]() K+ (aq) + OH – (aq)
K+ (aq) + OH – (aq)
b) Mg(OH)2(aq)![]() Mg2+(aq) + 2OH–(aq)
Mg2+(aq) + 2OH–(aq)
Propriedades funcionais: apresentam sabor cáustico (como no leite de magnésia); no estado líquido, conduzem corrente elétrica (fundido ou em solução aquosa) devido à presença de íons livres.