Leis gerais das mudanças de estado
Por Redação
Leis gerais das mudanças de estado
A primeira lei nos mostra que quando ocorre mudança de estado, consequentemente, não ocorrerá variação de temperatura, e vice-versa. Portanto, os dois fenômenos nunca acontecem simultaneamente.
1ª Lei: SE A PRESSÃO FOR MANTIDA CONSTANTE, DURANTE A MUDANÇA DE ESTADO A TEMPERATURA SE MANTÊM CONSTANTE.
A segunda lei nos mostra que tanto a temperatura de fusão como a de ebulição, em uma determinada pressão, são consideradas características das substâncias.
2ª Lei: PARA UMA DADA PRESSÃO, CADA SUBSTÂNCIA TEM A SUA TEMPERATURA DE FUSÃO (OU DE SOLIDIFICAÇÃO) E A SUA TEMPERATURA DE EBULIÇÃO (OU DE LIQUEFAÇÃO).
A terceira lei nos mostra que quanto maior a altitude, menor é a pressão e a temperatura de ebulição, portanto podemos concluir que a ebulição de um líquido, é dependente de sua pressão.
Ela diz o seguinte:
3ª Lei: VARIANDO A PRESSÃO AS TEMPERATURAS DE FUSÃO E DE EBULIÇÃOTAMBÉM VARIAM.
Curvas de aquecimento e de resfriamento
As curvas de aquecimento e de resfriamento podem ser obtidas através de um gráfico, construído em um diagrama cartesiano, da temperatura de um corpo de acordo com a quantidade de calor recebido e liberado pelo mesmo.
Exemplo:
| • Sabendo que um corpo de massa m de uma substância possui as seguintes temperaturas:
Fusão: ѳF Ebulição: ѳE • Considere ѳ1 (ѳ1 < ѳF) como a temperatura inicial do corpo. • Onde ѳ1 < ѳF sabemos que o corpo está em estado sólido (veja ponto A). • Cedendo calor ao corpo ele é aquecido, prevalecendo sólido até o ponto de fusão (veja ponto B). • Nesse momento, conforme o corpo for recebendo calor ele irá entrar em fusão mantendo a temperatura constante (veja patim BC) • Quando estiver completamente fundido (veja ponto C), o corpo estará em estado líquido, e será iniciado o processo de aquecimento. • O corpo continuará líquido até o ponto de ebulição (veja ponto D). • No processo de ebulição, a temperatura fica constante (veja patim DE). • Com a ebulição concluída (ver ponto E), o vapor começa a se aquecer (veja intervalo EF) até ѳ2. |
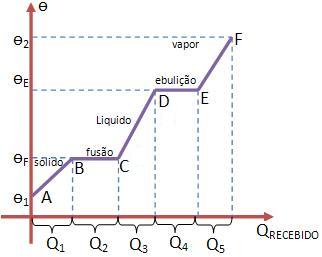 |
Podemos calcular as quantidades de calor recebidas pelo corpo para o aquecimento da seguinte maneira:
Q1 = m csólido (ѳF – ѳ1)
Q2 = m LF
Q3 = m clíquido (ѳE – ѳF)
Q4 = m LV
Q5 m cvapor (ѳ2 – ѳE)
Podemos obter a curva de resfriamento da mesma forma. É só imaginar as transformações de maneira inversa das que estão na curva de aquecimento.