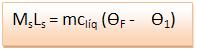Sobrefusão (ou superfusão)
Por Redação
Sobrefusão ou superfusão
A sobrefusão ou superfusão é considerado um fenômeno, que se constitui quando uma substância está no estado líquido, e em uma temperatura abaixo da própria temperatura de solidificação.
Podemos citar como exemplo o hipossulfito de sódio, onde a sobrefusão é muito comum ocorrer.
Para entendermos melhor, vamos observar a curva do diagrama abaixo, que representa o hipossulfito de sódio:
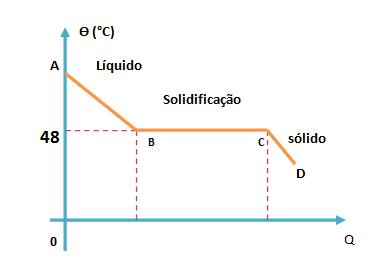
Com base no diagrama acima, podemos ver que o ponto de solidificação do hipossulfito de sódio é de 48°C, mas se pensarmos em resfriá-lo, lentamente, sem agitá-lo, o hipossulfito de sódio, poderá chegar a uma temperatura abaixo do seu normal, porém continuando no seu estado líquido.
Quando ocorrem fenômenos como este, podemos chamá-los de sobrefusão ou superfusão.
Quando o hipossulfito de sódio sofre uma sobrefusão, a sua curva em um diagrama, fica da seguinte forma:
Vejamos:
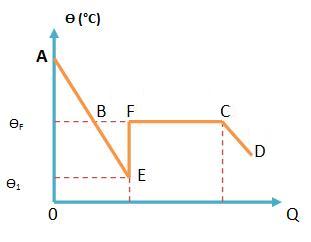
Com base no diagrama acima, podemos observar que o trecho AE, representa resfriamento do líquido, mesmo com o trecho BE estando em sobrefusão. Todo esse processo causa uma grande variação no sistema.
Ao ocorrer essa variação, o sistema sofre uma solidificação de uma parte de ms do total da massa m. A solidificação libera calor que fica armazenado no próprio sistema, provocando um grande aquecimento e o retorno da temperatura de solidificação.
Portanto:
QBF = QBE = QEF
A partir das considerações acima, podemos observar que tanto a solidificação parcial, como o aquecimento (trecho EF) são rápidos, por isso chamamos esse processo de adiabáticos, e conseqüentemente QEF = 0.
Portanto:
QBF = QBE
Logo: