10. Lei de Hess ou da aditividade dos calores de reação
Quando a reação química ocorre em um ou diversos estágios, a variação de energia térmica nesse processo é constante, pois a variação de energia depende apenas das propriedades das substâncias nos estados inicial e final.
A Lei de Hess é bastante utilizada para determinar indiretamente calor de reação.
O total de calor liberado ou absorvido nas reações sucessivas: A → B e B → C é equivalente ao calor liberado ou absorvido na reação: A → C
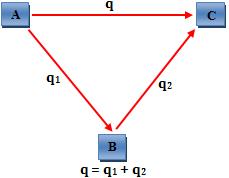
Analogamente, podemos dizer que:
“A variação de entalpia, ou seja, quantidade de calor liberada ou absorvida por um processo só depende do estado inicial e final do processo não dependendo das etapas intermediárias.”
A → B → D → C – calor completo – q1
A → B → C – calor completo – q2
A → C – calor completo – q3
q1 = q2 = q3
O calor liberado ou absorvido na reação A → C depende apenas do conteúdo energético de A e C