Diagrama de entalpia
Por Redação
18. Diagrama de entalpia
Segundo a Lei de Hess, a variação de entalpia, ou seja, quantidade de calor liberada ou absorvida por um processo só depende do estado inicial e final do processo não dependendo das etapas intermediárias.
Independente do caminho percorrido pelos dois estados, a variação de entalpia será a mesma.
Seja um sistema no qual o estado inicial será representado por A, e o estado final por D. Considere que existam dois caminhos, pelos quais podemos obter o estado final a partir do estado inicial.
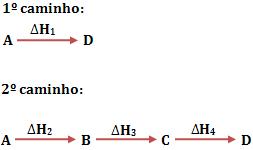
Veja abaixo a representação das entalpias dos vários estados por linhas horizontais:
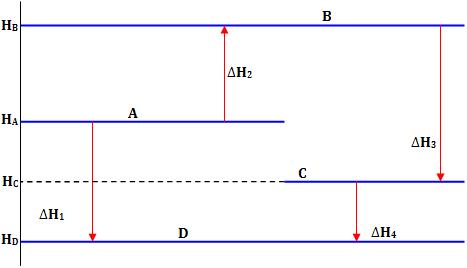
Logo, conforme a Lei de Hess, devemos ter:
HD – HA = ∆H1 = ∆H2 + ∆H3 + ∆H4
É por esta razão que a Lei de Hess é também conhecida como a lei da Atividade das Entalpias.
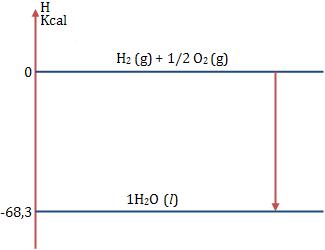
Dessa forma, é possível representar as variações de entalpia no formato de diagrama.
Exemplo:
Vamos representar 1 mol de H2O (l):