Calor de reação medido a volume constante e a pressão constante
Por Redação
9. Calor de reação medido a volume constante e a pressão constante
Como já sabemos, as reações químicas ocorrem, em sua maioria, em recipientes abertos, sob a pressão constante da atmosfera. Porém, quando os gases participam da reação, o calor da reação medido a pressão constante não será o mesmo do calor medido a volume constante.
Vamos analisar os casos abaixo:
1) Reação com expansão de volume
Exemplo:
2 C (sólido) + O2(g) → 2 CO(g) 1 mol 2 mols
– Calor medido a volume constante
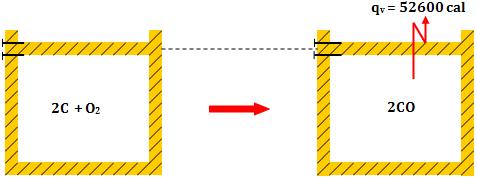
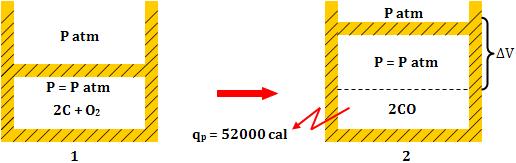
– Calor medido a pressão constante
Toda energia sob volume constante, originada da reação, é liberada na forma de calor (qv).
Sob pressão constante, o sistema é expandido, executando o trabalho ![]() . Logo, parte daquela energia originada da reação será utilizada na realização do trabalho
. Logo, parte daquela energia originada da reação será utilizada na realização do trabalho ![]() e o calor liberado (qp) será menor que o calor liberado a volume constante (qv).
e o calor liberado (qp) será menor que o calor liberado a volume constante (qv).
2- Reação com concentração de volume
Exemplo:
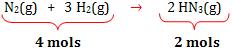
– Calor medido a volume constante
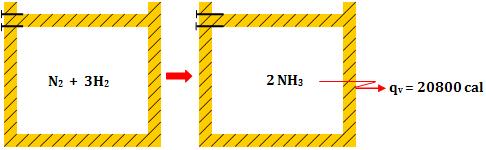
– Calor medido a pressão constante
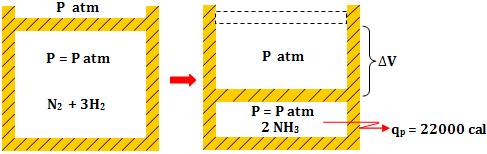
O ar atmosférico, sob pressão constante, executa um trabalho ![]() contrário ao sistema, que transfere para o exterior a mesma quantidade de calor. Portanto, o calor liberado sob pressão constante é maior que o calor liberado sob volume constante.
contrário ao sistema, que transfere para o exterior a mesma quantidade de calor. Portanto, o calor liberado sob pressão constante é maior que o calor liberado sob volume constante.
![]()
3) Não há variação de volume na reação
![]() = ∆n . R . T = 0, pois n2 = n1
= ∆n . R . T = 0, pois n2 = n1
Portanto: qp = qv
