16. Calor de formação
A entalpia H de um sistema não pode ser calculada experimentalmente, somente as diferenças ∆H. O calor de formação permitiu calcular a entalpia de várias sustâncias até então desconhecidas, a partir da variação de entalpia 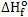
Estado padrão na termoquímica é caracterizado por:
– Temperatura de 25°C
– Pressão de 1atm.
– Estrutura cristalina ou alotrópica mais estável (se for o caso).
– Estado físico usual da substância.
Por convenção, substância simples ou elemento químico no estado padrão possui entalpia sempre zero.
Calor de formação é a quantidade de calor liberada ou absorvida na síntese de 1 mol da substância a partir de seus elementos no estado padrão (forma alotrópica mais estável, a 25°C e 1atm).
Levando em conta a convenção citada acima, podemos concluir que a entalpia H de uma substância é equivalente ao calor de formação (∆Hf) dessa substância.
Exemplos:
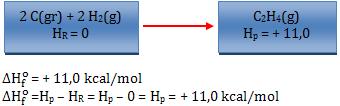
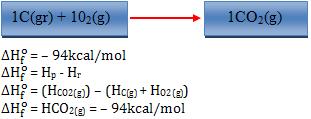
Observação:
– O sobrescrito “o” revela que a variação de entalpia foi medida nas condições padrão (25°C e 1 atm).

– O sinal (-) indica que o sistema perde.
– O sinal(+) indica que o sistema ganha.
Logo, quando o sinal for (-) significa que a síntese foi exotérmica, quando o sinal for (+) significa que a síntese foi endotérmica.