20 – Mecanismos de substituição em derivados halogenados
Na reação de substituição nucleofílica (S.N.), quem ataca o composto orgânico é o íon OH- (base de Lewis), considerado um reagente nucleófilo.
A) Mecanismo de hidrólise do brometo de metila (heleto de alcoíla primário)

Caminho da reação
I) Aproximação dos reagentes
Um átomo de bromo, eletrizado negativamente, repele o ânion OH– , atacando a molécula pelo outro lado.
II) Formação de um complexo ativado:
Neste complexo, a ligação HO – C começa a se formar, enquanto a ligação C – Br começa a se romper.
É necessária uma energia âHa para formar o complexo, pois as ligações do carbono com os átomos de hidrogênio foram distorcidos.
III) Separação dos produtos:
Os átomos de hidrogênio estão em posições estáveis.
O mecanismo é SN – 2, isto é, substituição nucleofílica de segunda ordem, ou seja, a velocidade da reação irá depender da concentração de R– X de OH–.
V = k [R – X] [OH–]
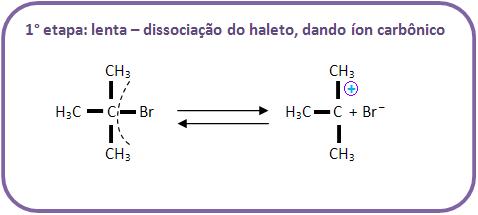
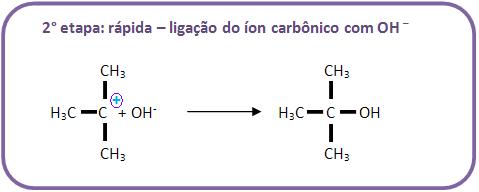
B) Mecanismo de hidrólise do brometo de tercbutila (haleto de alcoíla terciário)
Através de um mecanismo diferente chamado SN-1 (substituição nucleofílica de primeira ordem), a hidrólise dos haletos de alcoíla terciários irá se processar.
É difícil o ataque do OH– pelo lado oposto, pelo fato de haver um impedimento estérico (espacial) disposto pelos 3 grupos. Portanto, podemos concluir que o mecanismo é diferente e ocorre da seguinte maneira, vejamos: