Pontos de Fusão e de Ebulição
Por Redação
, atualizado em
Nos estados sólido e líquido, as moléculas encontram-se próximas umas das outras apresentando ligações intermoleculares (Van der Waals, dipolo-dipolo ou pontes de hidrogênio).
Ebulição é a passagem de uma substância do estado líquido para o gasoso. Já a fusão é a passagem do estado sólido para o estado líquido. Nos dois processos, ocorre um afastamento das moléculas que só será possível com o rompimento das ligações intermoleculares.
Resumo:
Fatores que influenciam a mudança de estado
1. Tamanho da Cadeia ou Peso Molecular
Quanto maior for a cadeia carbônica, maior será a superfície de contato entre as moléculas e o número de ligações intermoleculares. Com isso, a energia necessária para a mudança de estado (ruptura de ligações) será maior.
Exemplo:
![]()
2. Presença de Ramificações
A presença de uma ramificação diminui o contato entre as moléculas facilitando a ebulição da substância.
Exemplo:

3. Polaridade
Quanto maior for a polaridade de uma substância maior será a energia necessária para o rompimento de suas interações. Com isso, o ponto de ebulição aumenta.
Exemplo:
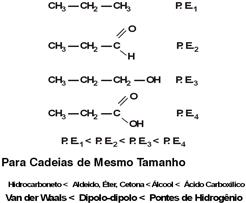 .
.
