4. Pressão máxima de vapor
Imagine um cilindro fechado contendo um líquido, com um espaço vazio acima da altura do líquido, e um manômetro. Com o nível de mercúrio dos dois ramos na mesma altura (figura a).
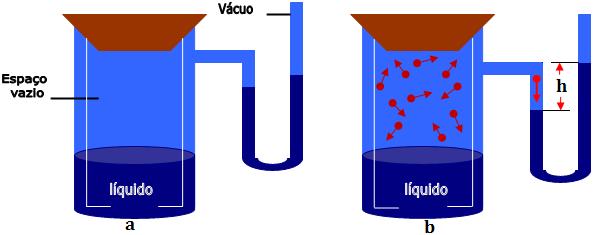
Primeiramente, as moléculas do líquido se deslocam para o espaço vazio do cilindro, formando a fase gasosa. A pressão exercida pelo vapor do líquido é medida pelo manômetro. Notamos que o nível do mercúrio sobe até certo ponto onde estaciona (figura b). A pressão exercida pelo vapor do líquido é medida pelo desnível h ente os dois níveis de mercúrio.
A pressão máxima de vapor é definida como a pressão exercida pelo vapor em equilíbrio.
Até que a velocidade de vaporização atinja o equilíbrio, ela é maior que a velocidade de condensação. Conforme a quantidade de vapor aumenta, a pressão do vapor também aumenta. A partir do momento em que o equilíbrio é alcançado, a concentração de moléculas na fase de vapor torna-se constante e a pressão não aumenta mais, ou seja, o seu valor máximo é atingido.
Como a superfície do líquido e a temperatura não se alteram, a velocidade de vaporização é constante.
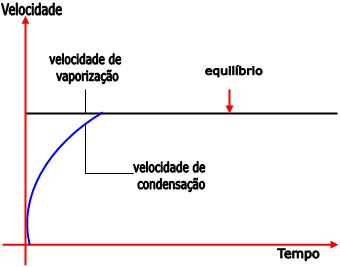
A velocidade de condensação torna-se igual à velocidade de vaporização no equilíbrio, ou seja, o número de moléculas que abandonam o líquido se iguala ao número de moléculas que voltam para o líquido.
A pressão máxima do vapor também pode ser chamada de pressão de vapor ou pressão de vapor de equilíbrio. Tal pressão é aquela que é exercida pelo vapor em equilíbrio com o seu líquido.
Quando o vapor está em equilíbrio com o seu líquido, ele é denominado vapor saturante.