6. Pressão de vapor e ponto de ebulição
Um líquido entra em ebulição quando a pressão de vapor do líquido torna-se igual a pressão existente sobre a superfície do líquido.
Quanto maior for a pressão de vapor nas condições ambientes, o líquido ferverá mais facilmente, isto significa que, quanto menor for o ponto de ebulição, mais volátil será o líquido.
Desse modo, sob uma temperatura de 20°C, a pressão máxima de vapor de água é 17,5mm de Hg e a pressão máxima de vapor do álcool é 44mm de Hg.
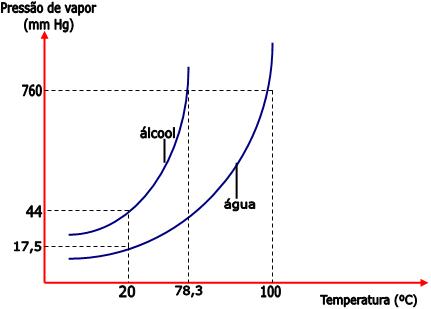
Observe no gráfico que, ao nível do mar (760 mmHg), o álcool etílico ferve a 78,3°C, e a água ferve a 100°C. Portanto, conforme a temperatura aumenta, a pressão máxima de vapor também aumenta. O álcool etílico entre em ebulição sob a temperatura de 78,3°C, pois nesta temperatura a sua pressão máxima de vapor se iguala à pressão atmosférica (760 mmHg à nível do mar). Já a pressão máxima de vapor da água se iguala a 760mm Hg sob a temperatura de 100°C.