Isomeria Espacial
Por Redação
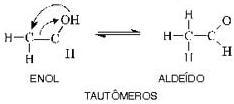
carbono do enol (en = dupla ligação; ol = álcool) “desloca-se” para o carbono (dizemos que o oxigênio sofreu uma “transposição”); simultaneamente, a dupla ligação que estava entre o primeiro e o segundo carbono se “desloca-se”, ficando agora entre o primeiro carbono e o oxigênio (dizemos que o composto todo sofreu um “rearranjo molecular”). No entanto a reação é reversível, isto é, o aldeído volta a transformar-se no enol inicial. Ora, sabemos que toda reação reversível tende para um equilíbrio dinâmico; é o que acontece com o par aldeído-enol mostrado antes, surgindo então o chamado equilíbrio aldo-enólico. Medidas feitas em laboratório mostram que, nesse equilíbrio, a maior porcentagem é sempre de aldeído, pois ele é o composto mais estável.
Cetona e enol
Como segundo exemplo, citamos o caso de equilíbrio entre uma cetona e um enol, que, na verdade, é totalmente idêntico ao caso anterior:
Isomeria Espacial
Os isômeros apresentam mesma fórmula molecular, mesma fórmula plana, mas diferentes fórmulas estruturais espaciais.
Divide-se em:
Isomeria Geométrica (ou Cis-Trans)
Em Compostos de Cadeia Acíclica com Dupla Ligação
Considere, com bastante atenção, os dois exemplos que serão dados a seguir:
1.° exemplo – Seja o composto ClCH2 – CH2Cl; podemos representá-lo pelo “modelo de bolas” das seguintes maneiras:

No entanto as três representações indicam a mesma coisa, pois trata-se da mesma estrutura espacial, isto é, do mesmo composto; de fato , a ligação simples entre os dois carbonos pode girar livremente; desse modo, basta “rodar” o carbono superior da estrutura “B” 120° para que ela coincida com a estrutura “A”; bem como “rodando” o carbono superior da estrutura “C” 120°, ela coincide com “B”, e continuando o “giro” por mais 120°, ela coincide com “A” . Enfim, sempre que houver superposição das figuras, elas estarão representando o mesmo composto.
2.° exemplo – Seja o composto ClCH = CHCl; usando-se o “modelo de bolas”, podemos ter as seguintes “arrumações” espaciais:
![]()
Repare no seguinte:
· Na primeira figura, os dois átomos de cloro estão do “mesmo lado” do plano que “divide” a molécula ao meio; esta é a chamada forma CIS (cis = mesmo lado).
· Na segunda figura, os dois átomos de cloro estão de “lados opostos” do plano que “divide” a molécula ao meio; esta é a chamada forma TRANS (trans = através ou transversal) .
