Estequiometria de reações
Leis Ponderais
Lei de Lavoisier ou Lei da Conservação da Massa – A soma das massas dos reagentes é igual à soma das massas dos produtos.
Lei de Proust ou Lei das Proporções Fixas – A proporção em massa das substâncias que reagem e que são produzidas em uma reação química é sempre constante e invariável.
Lei de Dalton ou Lei das proporções múltiplas – Quando duas substâncias simples reagem entre si para formar compostos diferentes, se a massa de uma delas permanecer constante, a massa da outra substância irá variar numa relação de números inteiros e múltiplos.
LEIS VOLUMÉTRICAS
1.a Lei de Gay-Lussac – Nas mesmas condições de temperatura e pressão os volumes gasosos de reagentes e produtos estão em uma proporção constante de números inteiros e pequenos.
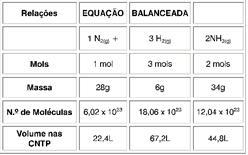
Ex.: 1N2(g) + 3H2(g) 22NH3(g)
12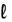
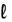
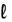
1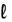
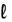
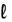
Proporção de números inteiros e pequenos:
1: 3: 2.
Observação: A Lei de Lavoisier não é válida para a conservação de volume. Na reação acima, 48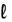
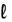
2.a Lei de Gay-Lussac – Quando duas substâncias na fase gasosa reagem entre si para formar compostos diferentes, se o volume de uma delas permanecer constante, o volume da outra substância irá variar numa relação de números inteiros e pequenos.
RELAÇÕES BÁSICAS PARA O CÁLCULO ESTEQUIOMÉTRICO
Os coeficientes de uma reação química balanceada indicam a proporção de cada substância que reage e que é produzida. Essa proporção pode ser em mols, massa, número de moléculas ou volume (para substâncias na fase gasosa). Exemplo:
sua constante de equilíbrio permanece inalterada (a constante permanece constante).
CASOS PARTICULARES
a) Quando são dadas as quantidades de dois reagentes – Geralmente ocorre em problemas com excesso de um dos reagentes.