Ionização por Etapas
Por Redação

Classificação das soluções aquosas:
a) água pura
H2O(l)+ H2O(l)![]() H3O 1+(aq) + OH1– (aq)
H3O 1+(aq) + OH1– (aq)
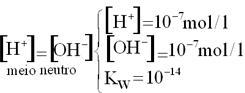
b) Adição de ácido à água pura
H2O(l)+ H2O(l)![]() H3O 1+(aq)+ OH–(aq)
H3O 1+(aq)+ OH–(aq)
HA(l) + H2O![]() H+(aq)+ A–(aq)
H+(aq)+ A–(aq) 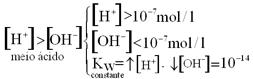
c) Adição de base à água pura
H2O(l)+ H2O(l) ![]() H3O1+(aq)+ OH– (aq)
H3O1+(aq)+ OH– (aq)
XOH(l) + H2O(l)![]() X+(aq)+ OH–(aq)
X+(aq)+ OH–(aq)
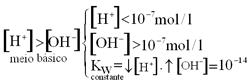
Ionização por etapas
Características:
1. O número de etapas de uma ionização é dado pelo número de hidrogênios ionizáveis do ácido.
2. Cada etapa da ionização constitui um sistema em equilíbrio à parte e, portanto, cada etapa tem a sua constante de ionização.
3. A força de um poliácido é dada pela sua 1.a ionização, pois à medida que o poliácido vai-se ionizando, sua constante de equilíbrio vai diminuindo, da 1.a para as demais, devido a dois fatores fundamentais:
1.° Efeito do íon comum.
2.° As pontes de hidrogênio intramolecular.
4. A constante de equilíbrio da reação global é dada pelo produto das constantes de equilíbrio das etapas intermediárias.
Contribuição de Sörensen
a) Potencial hidrogeniônico (pH)
pH = colog [H+]
pH = – log [H+]
![]() .
.
