Eletrólise ígnea
Por Redação
3. Eletrolise ígnea
É o tipo de eletrólise que ocorre com o material fundido, sem água.
Observações:
Na eletrólise, o cátodo é o pólo negativo e o ânodo é pólo positivo, sendo que tanto na pilha como na eletrólise no cátodo ocorre redução e no ânodo ocorre oxidação.
Chamamos de célula eletrolítica o aparelho que realiza a eletrólise.
Exemplo:
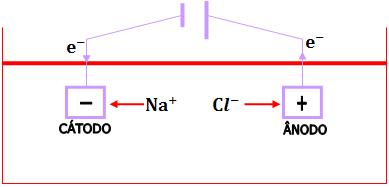
Eletrólise ígnea do NaCl.
Numa temperatura elevada de 801°C, o NaCl dissocia-se:
![]()
Os íons ganham liberdades graças á fusão. Atravessando corrente elétrica contínua pela célula eletrolítica, ocorre:
• Semi-reação da redução
O cátodo (pólo negativo) atrai os cátions Na+ que recebem elétrons, causando a sua descarga.
Origina-se o sódio metálico, Na(m).
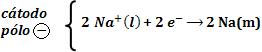
• Semi-reação de oxidação
O ânodo (pólo positivo) atrai os ânions Cl– que perdem elétrons, causando a sua descarga.
Origina-se o gás cloro, Cl2(g).
![]()
• Equação Global
Ao somar a equação de dissociação com as duas semi-equações de redução e oxidação, temos:
![]()
O processo de eletrólise ígnea obtém metais alcalinos, alcalinoterrosos e alumínios, pois esses são cátions que não descarregam em solução aquosa.
