8. Força de ácidos e bases
Segundo Brönsted, temos a seguinte definição:
“Força de um ácido é a intensidade com que fornece o próton. O ácido forte fornece próton com mais facilidade.”
“Força de uma base é a intensidade com que recebe próton. A base forte recebe próton com mais facilidade.”
Sabemos que, segundo Brönsted e Lowry, as reações ácido-base são reversíveis. Em equilíbrio, ambas as reações continuam com a mesma velocidade, e quantidade de cada espécie fica permanece constante no decorrer do tempo.
Exemplo:
Na reação do ácido acético com água, no equilíbrio, para cada 987 moléculas não-dissociadas, temos 13 íons H3O+.
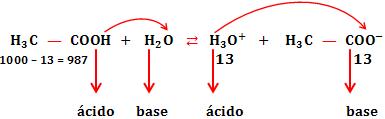
Portanto, temos no sistema, dois ácidos e duas bases. Sabendo que no equilíbrio, a concentração de H3O+ é menor do que a do H3C — COOH, concluímos que o H3O+ perde elétron com mais facilidade, ou seja, é ácido mais forte que H3C — COOH.
Analogicamente, a concentração de H3C — COO– é menor que a da água. Então, concluímos que a base H3C — COO– recebe próton com mais facilidade, ou seja, é base mais forte que H2O.
Conclusão:
A base e o ácido mais fortes estarão do mesmo lado na equação, e o ácido e a base mais fracos ficarão do outro lado. Tal fato pode ser ressaltado através de setas de tamanhos diferentes, indicando a reação direta e inversa.
