Cinética Química
Estuda as velocidades das reações químicas, bem como os fatores que podem modificá-las.
Considere a reação:
1N2(g) + 3H2(g) 2NH3(g)
A Vm pode ser calculada considerando D[ ] (variação da concentração molar em módulo):
Vm de consumo de 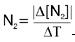

Vm de consumo de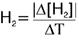

Vm de produção de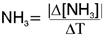

Unidade: 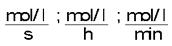
Para a velocidade média da reação temos:
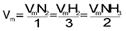
Observação: Para calcular a velocidade média da reação, basta dividir a velocidade de um dos participantes pelo seu próprio coeficiente.
Aplicação
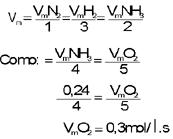
A combustão da amônia é representada pela equação química:
4NH3(s) + 5O2(g) 4NO(g) + 6H2O(g)
Mediu-se a velocidade da reação em determinado momento e observou-se que a amônia estava sendo queimada numa velocidade de 0,24 mol/ ls. Qual a velocidade de consumo do gás oxigênio?
Solução:
condições para que uma reação ocorra
1. Afinidade química Os reagentes devem ter tendência a entrar em reação.
2. Contato entre os reagentes A fim de que possa haver interação química.
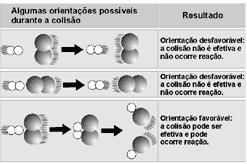
3. Choque bem orientado: